- Duración:
- 1 hora
- Agrupamiento:
- Grupo
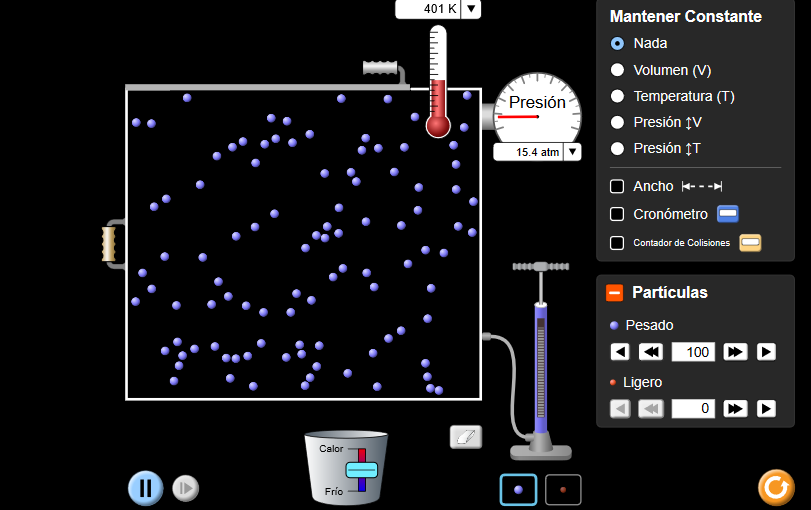
3. A modo de resumen y conclusión sobre las leyes de los gases
Completamos esta tabla:
| Relación |
¿Directa o inversa? |
Parámetros constantes |
¿De quién es la ley? |
Breve explicación del por qué según el modelo de partículas. |
| V vs P |
|
|
|
|
| V vs T |
|
|
|
|
| T vs P |
|
|
|
|
4. Escenarios
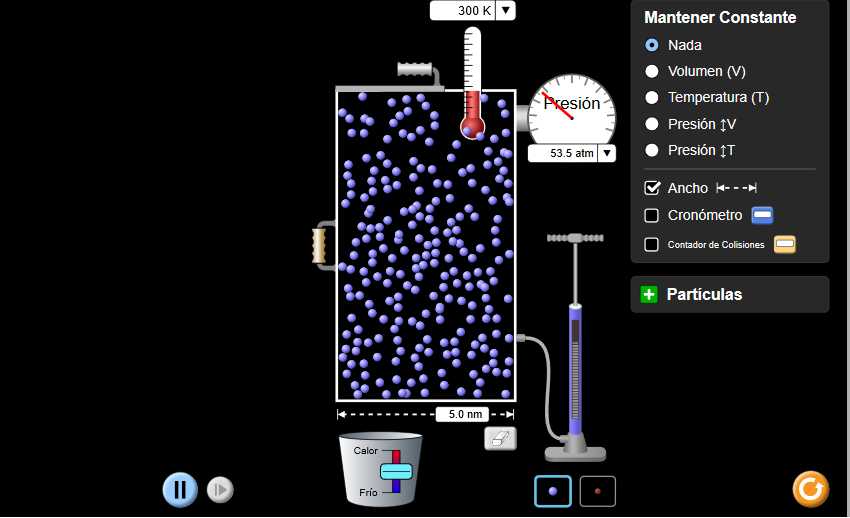
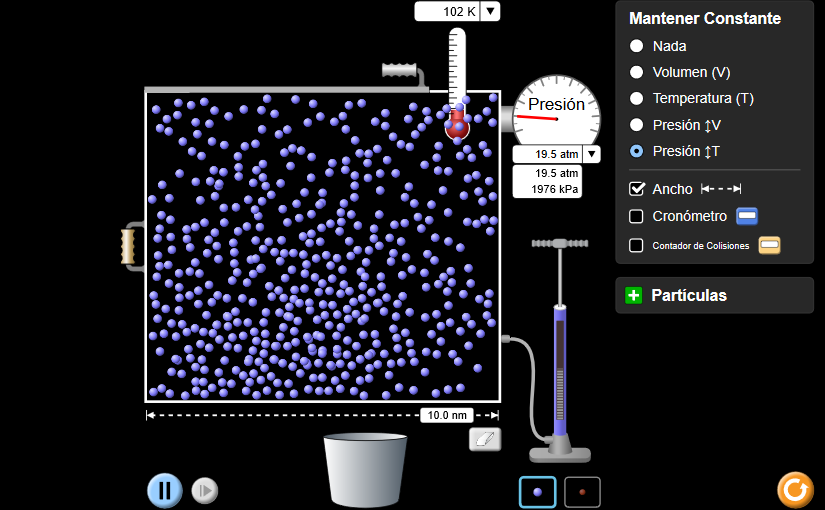
Usando las leyes de los gases, explicamos cada uno de los siguientes escenarios. En cada caso nos aseguramos de referirnos a qué gráfico puede usarse como evidencia para la respuesta.
- ¿Por qué los neumáticos de bicicleta parecen más planos en invierno que en verano?
- ¿Por qué una lata de refresco explota si se deja al sol?
- Un recipiente rígido lleno de gas se coloca en hielo (ejemplo: una botella de spray). ¿Qué pasará con la presión del gas? ¿Qué pasará con el volumen?
- Un diente infectado forma un absceso (área de tejido infectado) que se llena de gas. El absceso ejerce presión sobre el nervio del diente, causando dolor de muelas. Mientras esperaba ver a un dentista, la persona con dolor de muelas trató de aliviar el dolor tratando el área infectada con calor húmedo. ¿Le ayudará este tratamiento? ¿Por qué o por qué no?
5. Generalizando: Ley de los gases ideales
Los gases que cumplen con las leyes de Boyle-Mariotte, de Charles y de Gay-Lussac se denominan gases perfectos o ideales. Es posible combinar las leyes de los gases en una sola ecuación sencilla si la temperatura se si la temperatura se expresa en la escala absoluta o Kelvin. Así la ley de Charles y la de Gay- Lussac expresan, respectivamente:
V = k .T (1)
P= k .T (2)
Por otra parte la ley de Boyle establece la proporcionalidad inversa entre V y P, es decir:
V= k (3)
Combinando estas ecuaciones, tenemos que P.V/T = K. El producto de la presión por el volumen dividido entre la temperatura en grados kelvin es una constante; o dicho de otro modo:
P1.V2/T1 = P2.V2/T2
Ahora vamos a aplicar esta ley generalizada a dos situaciones:
- Se libera una burbuja de 25 mL del tanque de oxígeno de un buzo que se encuentra a una presión de 4 atmósferas y a una temperatura de 11°C. ¿Cuál es el volumen de la burbuja cuando ésta alcanza la superficie del océano, dónde la presión es de 1 atm y la temperatura es de 18 °C?
- Un globo aerostático de 750 mL se infla con helio a 8 °C y a una presión de 380 atmósferas ¿Cuál es el nuevo volumen del globo en la atmósfera a presión de 0,20 atm y temperatura de – 45 °C?